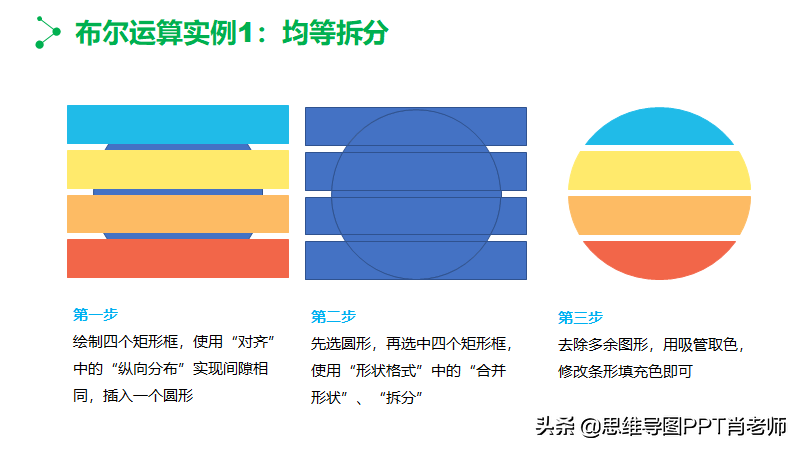
使用植物荧光成像仪对荧光数据的采集
依次取出待测的各组番茄植株,在黑暗环境下暗适应30分钟。在黑暗环境下,依次利用双通道PAM-100荧光仪的快速连续检测模式(图4.1A),测量5组受胁迫植株及对照植株的叶片,得到荧光值和对应的时间的曲线(OJIP曲线),并将数据导出至Excel中。
使用植物荧光成像仪(浙江大学现代光学仪器国家重点实验室)测定每组植株叶片的光系统II实际光化学效率,即Y(II)值(图4.1B),设置测量光强度为5,光化光强度为12(230μmolm-2s-1),饱和光强度为5(1530μmolm-2s-1),测量光频率为8Hz。
数据测定完成后,保存到Excel表格中,利用origin8.5软件处理。
双通道PAM-100荧光仪的快速连续检测数据处理方法:首先,使用测得的荧光值和对应的时间,按自定义公式f=(F-F0.1)/(Fm-F0.1)计算特定时间段内变量f的数值,其中F表示0.1~2.98毫秒时间段内任意时间点的荧光值。
F0.1表示0.1毫秒时间点对应的荧光值;Fm表示一次完整的测量过程(0~309.97毫秒)中最大的荧光值。然后,以时间为横坐标,f值为纵坐标,利用origin软件做出散点图,拟合曲线。最后,求得曲线初始斜率k0(0.1毫秒对应的斜率)。
具体操作如下:复制0.1~2.98毫秒时间段内的98个f值到origin中,以时间为横坐标,f值为纵坐标,依次点击“Plot”“Symbol”“Scatter”,做出散点图(图4.2A)。
选中散点图后,依次点击“Analysis”“Fitting”“ExponentialFit”“Openthedialog”“Function”“ExpDecay3”“Fit”,完成曲线拟合(图4.2B)。
选择新拟合的曲线(图4.2C),选中其对应的横坐标与纵坐标的数据,即“FitExpCurvel”表格中的前两列,依次点击“Analysis”“Mathematics”“Differentiate”,记录横坐标0.1处的数值k0,即为曲线的初始斜率(图4.2D)。
植物荧光成像仪测定的Y(II)值的处理方法:
使用植物荧光成像分析软件(版本2.118),选择成像模式为Y(II),设置观测区域大小为宽40,高50,读取并记录每张叶片的Y(II)值。
以k0为横坐标,对应的Y(II)值为纵坐标,用origin软件做出散点图(图4.3)。观察散点图发现,不同胁迫处理对应的[k0,Y(II)]在坐标系中呈现聚集式分布。
这说明不同胁迫处理下,叶绿素荧光特征值[k0,Y(II)]的变化是不同的。
不同胁迫处理对应的叶绿素荧光特征值的聚类分析:将4.2.1所得散点图中的数组[k0,Y(II)]进行编号,利用SPSS统计软件进行系统聚类分析,聚类方法选用“质心聚类法”,度量标准选用“Euclidean距离”,得出树状图(图4.4)。
其中,代表对照,代表干旱胁迫,代表病害胁迫;代表高温胁迫,代表弱光胁迫,代表缺素胁迫。根据聚类分析的结果,在散点图上圈出同类点集,并确定这些点集的值域。
不难发现,不同类型植株所对应散点基本被聚为一类。
不同胁迫处理对叶绿素荧光特征值的影响:根据聚类分析的结果,我们将4.2.1中所得叶绿素荧光特征值的散点图划分为对照,干旱,缺素,其他(病害、高温和弱光)4个部分,如图4.5。
(1)首先我们观察到5种受胁迫番茄植株的Y(II)全部低于0.4,而对照植株Y(II)全部高于0.4。
(2)继续观察图4.5发现,5种胁迫处理的叶绿素荧光特征值被划归为3个区域,且3个区域的k0值各不相同。
具体地,干旱胁迫k0值均小于2.5,病害、高温和弱光胁迫的k0值处于3.0~5.0之间,而缺素胁迫k0值均大于5.0。
利用叶绿素荧光成像仪和双通道PAM-100荧光仪相结合的方法,快速测量不同胁迫处理下番茄叶片的叶绿素荧光特征值,按特定的规则处理数据,得到一个曲线初始斜率的数值k0,与直接测得的实际光化学效率Y(II)共同组成数组[k0,Y(II)]。
我们发现,不同胁迫诱导的[k0,Y(II)]在坐标系中呈现出聚类分布。
就Y(II)来说,胁迫处理的番茄植株,其Y(II)的值均显著低于对照组,与Zhao等人(2000)的研究结果一致。反过来,根据Y(II)的值我们可以快速判断出植株是否受到胁迫。
就斜率k0来说,干旱胁迫诱导的k0值低于对照,可能是因为干旱导致光系统II接收的光能以热能的形式散失,用于光化学反应的能量大幅下降,从而导致电子产额降低。